Sulforaphane é um fitoquímico, uma substância dentro do grupo isotiocianato de compostos organosulfurados, encontrado em vegetais crucíferos, como brócolis, repolho, couve-flor e couve de Bruxelas. Ele também pode ser encontrado em bok choy, couve, couve, mostarda e agrião. Estudos de pesquisa mostraram que o sulforafano pode ajudar a prevenir vários tipos de câncer ativando a produção de Nrf2, ou fator nuclear relacionado ao eritroide 2, um fator de transcrição que regula os mecanismos antioxidantes de proteção que controlam a resposta da célula aos oxidantes. O objetivo do seguinte artigo é descrever a função do sulforafano.
Conteúdo
Sumário
O sistema antioxidante KEAP1-Nrf2-ARE é o principal meio pelo qual as células respondem a estresses oxidativos e xenobióticos. O sulforafano (SFN), um isotiocianato eletrofílico derivado de vegetais crucíferos, ativa a via KEAP1-Nrf2-ARE e tornou-se uma molécula de interesse no tratamento de doenças nas quais o estresse oxidativo crônico desempenha um papel etiológico importante. Nós demonstramos aqui que as mitocôndrias de células epiteliais de pigmento da retina (RPE-1) humanas cultivadas tratadas com SFN sofrem hiperfusão que é independente tanto de Nrf2 quanto de seu inibidor citoplasmático KEAP1. Foi relatado que a fusão mitocondrial é citoprotetora ao inibir a formação de poros nas mitocôndrias durante a apoptose e, consistente com isso, mostramos a citoproteção independente de Nrf2 de células tratadas com SFN expostas ao apoptose-indutor, estaurosporina. Mecanisticamente, o SFN atenua o recrutamento e / ou a retenção do fator de fissão solúvel Drp1 às mitocôndrias e aos peroxissomas, mas não afeta a abundância geral do Drp1. Estes dados demonstram que as propriedades benéficas do SFN se estendem além da ativação do sistema KEAP1-Nrf2-ARE e garantem uma interrogação adicional, dado o uso atual deste agente em múltiplos ensaios clínicos.
Palavras-chave: Sulforafano, Nrf2, Drp1, Mitocôndria, Fissão, Fusão, Apoptose
Introdução
Sulforafano é um inibidor independente da fissão mitocondrial Nrf2
Sulforafano (SFN) é um composto de isotiocianato derivado na dieta mais comumente de vegetais crucíferos [56]. É gerado em plantas como uma resposta xenobiótica à predação via liberação vesicular da enzima hidrolítica mirosinase de células danificadas; esta enzima converte glucosinolatos em isotiociantes [42]. Nas duas últimas décadas, a SFN tem sido amplamente caracterizada por suas propriedades antineoplásicas, antioxidantes e antimicrobianas [57]. Grande parte dessa eficácia tem sido atribuída à capacidade do SFN modular a via de sinalização do elemento de resposta antioxidante KEAP1-Nrf2 (ARE), embora atividades adicionais do composto tenham sido identificadas, incluindo a inibição da atividade da histona deacetilase e da progressão do ciclo celular. 29]. Nrf2 é o principal fator de transcrição antioxidante e, sob condições de homeostase, sua estabilidade é suprimida através da ação do complexo citoplasmático de ubiquitina ligase Cullin3KEAP1 [20]. Especificamente, o Nrf2 recrutado para a ligase Cullin3KEAP1 por ligao ao adaptador de substrato dimico KEAP1 e subsequentemente modificado com cadeias poliUb que visam o factor de transcrio para a degradao mediada por proteassoma. Este volume de negócios constitutivo limita a meia-vida do Nrf2 em células não-tensionadas para ~ 15 min [30], [33], [46], [55]. Em resposta a numerosos tipos de estresse, principalmente o estresse oxidativo, KEAP1, uma proteína rica em cisteína, atua como um sensor redox, e a modificação oxidativa de cisteínas críticas, particularmente C151, de KEAP1 dissocia NRF2-KEAP1 de CUL3, prevenindo a degradação de Nrf2. 8], [20], [55]. Notavelmente, o SFN, e possivelmente outros ativadores Nrf2, mimetizam o estresse oxidativo modificando o C151 de KEAP1, por exemplo, [21]. A estabilização do Nrf2 permite a sua translocação para o núcleo, onde induz a expressão de uma bateria de genes antioxidantes e de desintoxicação da Fase II. O Nrf2 liga-se aos elementos promotores da resposta antioxidante (ARE) dos seus genes alvo cognatos através da heterodimerização com pequenas proteínas Maf [19]. Este sistema apresenta uma resposta dinâmica e sensível a antioxidantes indiretos como o SFN, os radicais livres gerados pelas mitocôndrias [16] ou outras fontes fisiológicas de estresse oxidativo [41].
As mitocôndrias são organelas subcelulares dinâmicas que regulam uma série de funções celulares que vão desde a produção de ATP e tamponamento de cálcio intracelular até a regulação redox e apoptose [13], [49]. As mitocôndrias também representam a principal fonte de espécies reativas de oxigênio (EROs) dentro da célula. A regulação adequada da função mitocondrial é, portanto, necessária para otimizar a produção de ATP para atender às necessidades celulares e, ao mesmo tempo, minimizar os efeitos potencialmente prejudiciais da produção excessiva de radicais livres. Um requisito crítico para a modulação fina da função mitocondrial é a capacidade de as mitocôndrias funcionarem independentemente como máquinas bioquímicas e como parte de uma vasta rede responsiva.
A morfologia e a função da rede mitocondrial são determinadas por um balanço regulado entre a fissão e a fusão. A fissão mitocondrial é necessária para a herança de células filhas de mitocôndrias durante a divisão celular [28], bem como para a degradação seletiva e autofágica de mitocôndrias despolarizadas ou danificadas, denominada mitofagia [1]. Por outro lado, a fusão é necessária para a complementação de genomas mitocondriais e compartilhamento de componentes da cadeia de transporte de elétrons entre as mitocôndrias vizinhas [54]. No nível molecular, a fissão e a fusão mitocondrial são reguladas por grandes GTPases do tipo dinamínico. Três enzimas regulam principalmente a fusão: Mitofusinas 1 e 2 (Mfn1 / 2) são proteínas de membrana externa de duas passagens que medeiam a fusão da membrana externa via interações heterotípicas entre mitocôndrias adjacentes [15], [25], [37], enquanto OPA1 é uma proteína de membrana que garante simultaneamente a conectividade da matriz, regulando a fusão das membranas internas [5]. A atividade GTPase de todas as três proteínas é necessária para a fusão robusta [5], [18] e OPA1 é ainda regulada por proteólise complexa dentro da membrana interna mitocondrial pelas proteases OMA1 [14], PARL [6] e YME1L [45 ]. É importante ressaltar que o potencial de membrana mitocondrial intacta é necessário para a fusão eficiente, a fim de suprimir a integração de mitocôndrias danificadas e saudáveis [26].
A fissão mitocondrial é principalmente catalisada por uma proteína citosólica chamada proteína relacionada à Dynamin 1 (Drp1 / DNM1L). O Drp1 é recrutado do citosol para sítios prospectivos de fissão na membrana externa mitocondrial [43]. Os principais receptores para Drp1 na membrana externa são o fator de fissão mitocondrial (Mff) [32] e, em menor extensão, a Fissão 1 (Fis1) [51]. Adicionalmente, foi descoberto um receptor chamariz, MIEF1 / MiD51, que atua para limitar ainda mais a atividade da proteína Drp1 em potenciais locais de fissão [58]. Uma vez ancorados na membrana externa mitocondrial, o Drp1 se oligomeriza em estruturas em espiral ao redor do corpo da mitocôndria e, em seguida, utiliza a energia derivada da hidrólise do GTP para mediar a cisão física das membranas externa e interna mitocondrial [17]. Túbulos derivados do retículo endoplasmático atuam como um constritor inicial de mitocôndrias antes da oligomerização Drp1, ressaltando a revelação de que as mitocôndrias não constritas são mais largas que a circunferência permissiva de uma espiral Drp1 completa [12]. A dinâmica da actina também é importante para as interações ER-mitocôndrias que precedem a fissão mitocondrial [24]. Além de seu papel na fissão mitocondrial, o Drp1 catalisa a fissão de peroxissomas [40].
O Drp1 é muito semelhante à proteína dinamina bem caracterizada pelo fato de que ambas as proteínas contêm um domínio GTPase N-terminal, um domínio Médio que é crítico para auto-oligomerização e um domínio efetor GTPase C-terminal [31]. Drp1 alcança seletividade para membranas mitocondriais através de uma combinação de interações com suas proteínas receptoras Mff e Fis1 e também através de sua afinidade pela cardiolipina fosfolipídica específica das mitocôndrias via o domínio único de inserção B de Drp1 [2]. Drp1 normalmente existe como um homotetrâmero no citoplasma, e montagem de ordem superior nos locais de fissão mitocondrial é mediada pelo domínio do meio de Drp1 [3].
Dada a ligação implícita entre a função mitocondrial e a via KEAP1-Nrf2-ARE, investigamos os efeitos da ativação de Nrf2 na estrutura e função mitocondrial. Nós demonstramos aqui que o SFN induz a hiperfusão mitocondrial que, inesperadamente, é independente tanto de Nrf2 quanto de KEAP1. Este efeito do SFN é através de uma inibição da função Drp1. Demonstramos ainda que SFN confere resistência à apoptose que é independente de Nrf2 e mimetiza aquela observada em células depletadas de Drp1. Esses dados coletivamente indicam que, além de estabilizar e ativar o Nrf2, o SFN modula a dinâmica mitocondrial e preserva a aptidão e a sobrevivência celular.
Resultados
O sulforafano induz a hiperfusão independente de Nrf2 / KEAP1 de Mitocondria
No decorrer do estudo dos efeitos da ativação Nrf2 na dinâmica da rede mitocondrial, descobrimos que o tratamento de células epiteliais de pigmento retiniano (RPE-1) imortalizadas com sulforafano (SFN), um potente ativador da sinalização Nrf2, induziu uma fusão robusta de a rede mitocondrial quando comparada com células de controlo tratadas com veículo (Fig. 1A e B). A morfologia das mitocôndrias nessas células se assemelhava muito à mitocôndria das células depletadas pelo siRNA do Drp1 endógeno, o principal fator de fissão mitocondrial (Fig. 1A). Este resultado levantou a idéia intrigante de que a fissão mitocondrial e o status de fusão respondem diretamente aos níveis de Nrf2 na célula. No entanto, a estimulação de células com outros estabilizadores e ativadores Nrf2, tais como o inibidor de proteassoma MG132, o pro-oxidante tBHQ, ou o knockdown do inibidor de Nrf2 KEAP1, não induziu a fusão mitocondrial (Fig. 1A e B). A estabilização de Nrf2 por estas manipulações foi confirmada por Western blotting para Nrf2 endógena (Fig. 1C). Além disso, a expressão de Nrf2 foi dispensável para a fusão mitocondrial induzida por SFN, uma vez que o silenciamento de Nrf2 endógeno com siRNA falhou em contrariar este fenótipo (Fig. 1D-F). Como o SFN estimula a via KEAP1-Nrf2-ARE pela modificação covalente dos resíduos de cisteína de KEAP1 [21], derrubamos o KEAP1 para avaliar se a hiperfusão mitocondrial induzida por SFN é estimulada por uma via independente de KEAP1, mas independente de Nrf2. No entanto, a depleção de KEAP1 também não anulou a fusão mitocondrial induzida pelo SFN (Fig. 1G-I). De fato, o SFN reverteu a morfologia pró-fissão induzida pela depleção de KEAP1 (Fig. 1G, painel b versus painel d). Esses resultados indicam que o tratamento com SFN causa a fusão mitocondrial independente da via canônica KEYNGXX-Nrf1-ARE e nos levou a questionar se o SFN afeta diretamente os componentes da fissão mitocondrial ou do maquinário de fusão.
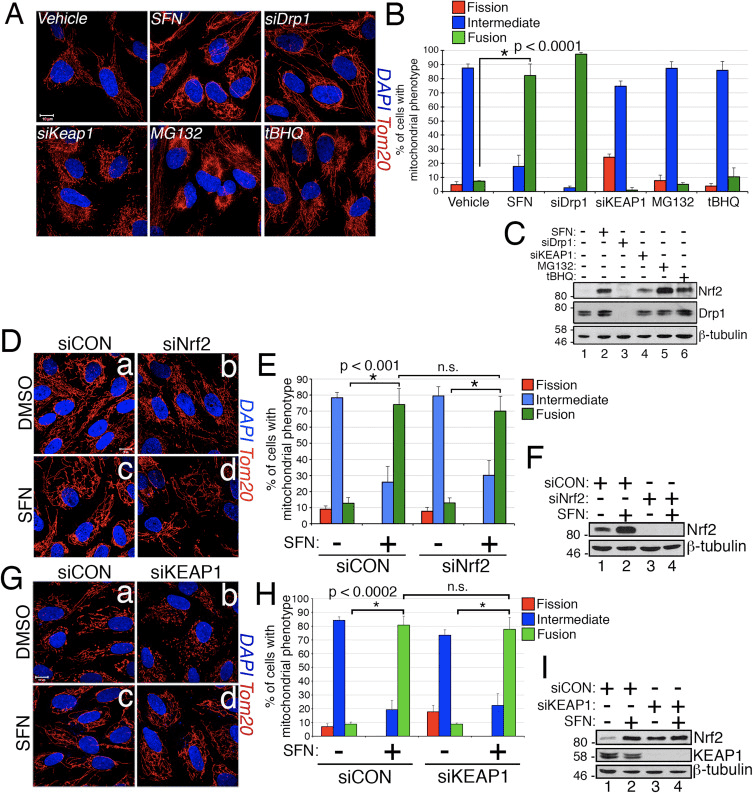
Sulforafano prejudica a associação mitocondrial de Drp1
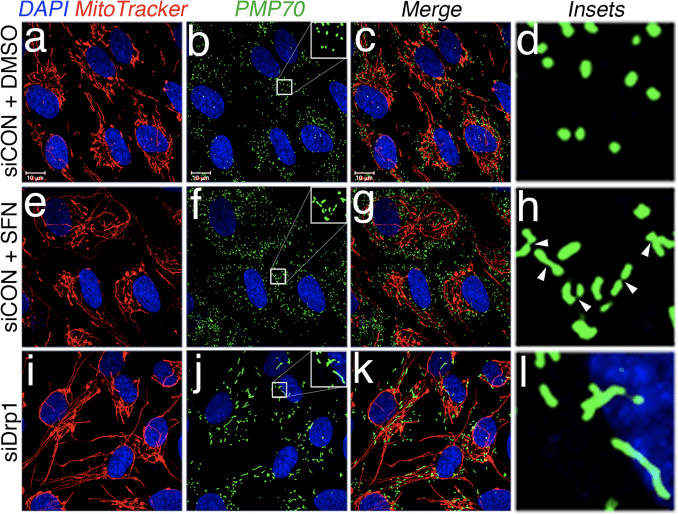
Com base na constatação de que o tratamento com SFN induz a hiperfusão mitocondrial, raciocinamos que esse fenótipo era uma consequência da atividade excessiva de fusão ou uma inibição da atividade da fissão. Para discriminar entre essas duas possibilidades, comparamos a morfologia dos peroxissomas na presença e ausência de SFN. Os peroxissomos são semelhantes às mitocôndrias, pois são organelas dinâmicas cuja forma e comprimento estão constantemente em fluxo [44]. Os peroxissomos contêm tanto Fis1 quanto Mff em sua membrana externa e, como conseqüência, são alvos para a fissão mediada por Drp1 [22], [23]. No entanto, os peroxissomos não utilizam a maquinaria de fusão da rede mitocondrial e, consequentemente, não são submetidos à fusão [39]. Pelo contrário, a fissão peroxisomal é oposta pelo aumento dos peroxissomos existentes através da adição de novo de membranas e proteínas [44]. Como os peroxissomas carecem de Mfn1 / 2 e OPA1, concluímos que se o SFN ativasse a maquinaria de fusão em vez de inibir a maquinaria de fissão, o comprimento do peroxissoma não seria afetado. Nas células tratadas com veículo, os peroxissomos são mantidos como organelas puntiformes curtas e arredondadas (Fig. 2, painéis b e d). Entretanto, o tratamento com SFN aumentou o comprimento do peroxissoma em ~ 2 vezes em comparação com as células controle (Fig. 2, painéis f e h). Além disso, muitos dos peroxissomos estavam comprimidos perto do centro, indicando um potencial defeito de cisão (Fig. 2, painel h, cabeças de setas). Da mesma forma, os peroxissomas em células transfectadas com siRNA Drp1 eram anormalmente longos (Fig. 2, painéis j e l), confirmando que Drp1 é necessário para fissão peroxisomal e sugerindo que o tratamento com SFN causa fenótipos mitocondriais e peroxissômicos ao interromper a maquinaria de fissão.
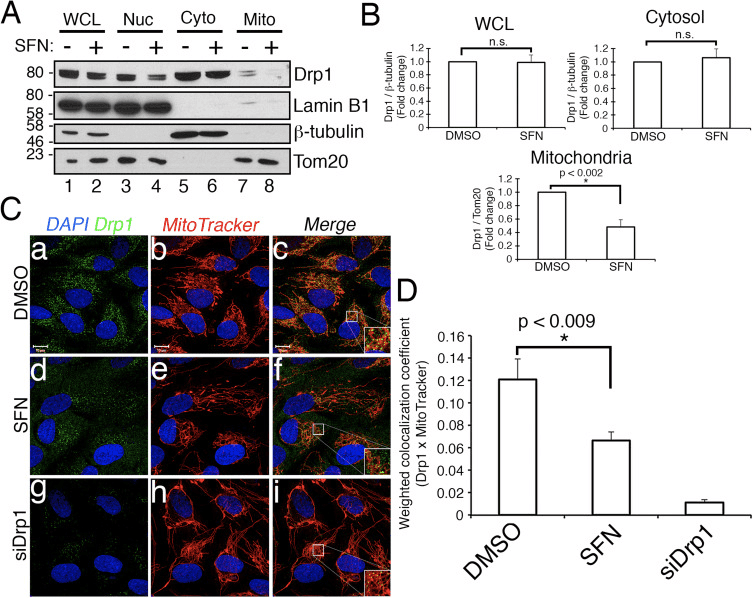
Em seguida, determinamos como o SFN restringe a função Drp1. As possibilidades incluíram reduções nos níveis de expressão, recrutamento / retenção na mitocôndria, oligomerização ou atividade enzimática da GTPase. Um déficit em qualquer um deles resultaria em redução da fissão e hiperfusão mitocondrial. Não detectamos alterações reprodutíveis nos níveis de proteína Drp1 após tratamento com SFN (Figs. 1C e 3A
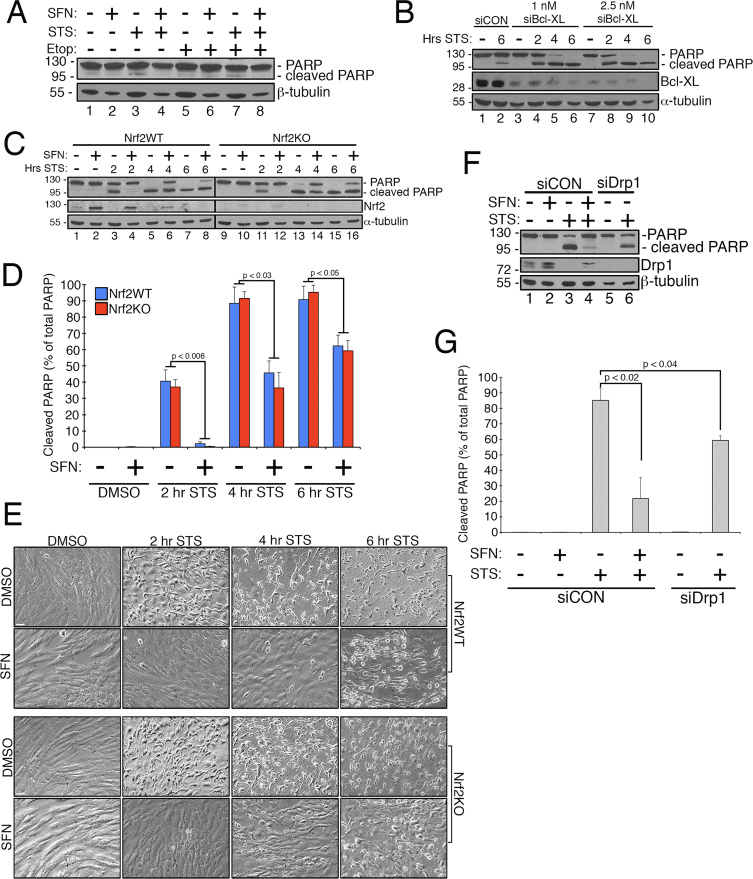
Sulforafano confere proteção contra apoptose induzida por estaurosporina independente de Nrf2
Trabalhos anteriores mostraram que a fissão mitocondrial é permissiva na formação de poros na membrana mitocondrial externa gerada por Bax / Bak durante a apoptose [11]. Demonstrou-se que o Drp1 é recrutado seletivamente para as mitocôndrias durante a apoptose [11] e, de acordo com isso, mitocôndrias fragmentadas foram observadas no início do processo [27]. Por outro lado, acredita-se que a inibição da fissão mitocondrial inibe a apoptose bloqueando a formação dos poros da membrana externa que permitem a liberação do citocromo c [53]. Consequentemente, a estimulação da fusão mitocondrial retarda a progressão da apoptose induzida por compostos, incluindo estaurosporina (STS) [14]. Para determinar se o SFN protege as células RPE-1 da apoptose mediada por STS e, em caso afirmativo, se isso requer Nrf2, estabelecemos um ensaio para induzir facilmente a clivagem poli-ADP ribose polimerase (PARP), um substrato de caspase-3 e
Discussão
Descobrimos que o SFN modula a dinâmica de fissão / fusão mitocondrial independente de seus efeitos na via KEAP1-Nrf2-ARE. Isso é intrigante por causa de uma suposta ligação entre a disfunção mitocondrial e a produção de ROS e a necessidade de eliminar radicais livres derivados de mitocôndrias através da ativação de Nrf2. Este impacto funcional adicional da SFN é de importância potencial, dados os mais de 30 ensaios clínicos em andamento testando SFN para o tratamento de uma variedade de doenças, incluindo câncer de próstata, doença pulmonar obstrutiva e doença falciforme [7], [10], [ 47].
Como o SFN é um isotiocianato [56] e ativa a sinalização Nrf2 pela acilação direta de cisteínas KEAP1 críticas para suprimir a degradação Nrf2 [21], segue-se que o SFN exerce seus efeitos pró-fusão modulando a atividade de um fator de fissão ou fusão via modificação de cisteína . Nossos dados apoiam fortemente que o Drp1 seja regulado negativamente pelo SFN, embora a GTPase seja um alvo direto de acilação permanece por esclarecer. Apesar dessa lacuna de conhecimento, a função do Drp1 está claramente sendo comprometida pelo SFN, já que tanto as mitocôndrias quanto os peroxissomos se tornam
Materiais e Mmétodos
Ensaios de Apoptose
As células foram semeadas e transfectadas com siRNA como indicado abaixo. As células foram pré-tratadas com sulforafano 50 µM por 2 h para induzir a fusão mitocondrial e foram então tratadas com estaurosporina 1 µM para induzir apoptose. No momento da colheita, o meio foi coletado em tubos individuais e submetido a centrifugação de alta velocidade para sedimentar células apoptóticas. Este sedimento celular foi combinado com células aderentes e solubilizado em tampão Laemmli concentrado 2 vezes. As amostras foram submetidas a western blotting anti-PARP.
Geração de Construções CRISPR / Cas9
Para criar o LentiCRISPR / eCas9 1.1, o LentiCRISPR v2 (addgene #52961) foi primeiro cortado com Age1 e BamH1. Em seguida, SpCas9 de eSpCas9 1.1 (addgene #71814) foi amplificado por PCR com prolongamentos Age1 e BamH1 usando os seguintes primers (Forward AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC, Reverse AAGCGCGGATCCCTTTTTCTTTTTTGCCTGGCCGG) e ligado no vector de corte acima. As sequências de sgRNA foram determinadas usando Benchling.com. Os parâmetros foram definidos para direcionar a sequência de codificação com os maiores pontuações no alvo e mais baixos fora do alvo. As seguintes sequências (sequência de direccionamento sublinhadas, hs sgNFE2L2 # 1 sentido CACCGCGACGGAAAGAGTATGAGC, anti-sentido AAACGCTCATACTCTTTCCGTCGC; hs sgNFE2L2 # 2 sentido CACCGGTTTCTGACTGGATGTGCT, AAACAGCACATCCAGTCAGAAACC anti-sentido; hs sgNFE2L2 # 3 sentido CACCGGAGTAGTTGGCAGATCCAC, anti-sentido AAACGTGGATCTGCCAACTACTCC) foram emparelhados e ligados em BsmB1 cortar LentiCRISPR / eCas9 1.1. Células RPE-1 infectadas por lentivírus foram selecionadas com puromicina e mantidas como uma população agrupada. Knockout foi confirmado por imunofluorescência e western blotting.
Cultura de células e transfecções
As células epiteliais pigmentares da retina humana transformadas com telomerase (RPE-1) (ATCC) foram cultivadas em meio de Eagle modificado por Dulbecco (DMEM) contendo 1 g / L glucose suplementada com penicilina, estreptomicina, 1X cocktail de aminoácidos não essenciais (Life Technologies), e 10% de Soro Bovino Fetal (Life Technologies). Para transfecções de siRNA, as células 30,000-35,000 / mL foram semeadas durante a noite. As células receberam ARNsi 10 nM diluído em DMEM isento de soro e combinado com o reagente de transfecção Interferina 0.3% (PolyPlus). Para a sensibilização da apoptose, as células receberam o siRNA BNLX-1 nM. As células foram colhidas 2-3 dias pós-transfecção.
Produtos Químicos, Anticorpos e siRNA Oligos
Anticorpos contra? -Tubulina (Cell Signaling),? -Tubulin (Sigma), Drp1 (BD Biosciences), KEAP1 (Proteintech), Lamin B1 (Abcam), PARP (Cell Signaling), PMP70 (Abcam) e Tom20 (BD Biosciences ) foram usados em diluições de 1: 1000 para western blotting e para imunofluorescência. Interno, o anticorpo de coelho anti-Nrf2 foi usado a 1: 2000 para western blotting [34], [59]. Sulforafano (Sigma) e estaurosporina (Tocris) foram usados a 50? M e 1? M, respectivamente. siRNAs contra Drp1 (Dharmacon), Nrf2 (Dharmacon), KEAP1 (Cell Signaling) e Bcl-XL (Cell Signaling) foram usados a 10 nM, salvo indicação em contrário.
Imunofluorescência e Rotulagem in Vivo
As células semeadas em lamínulas de vidro de 18 mm foram tratadas com veículo ou droga, fixadas em formaldeído a 3.7% e depois permeabilizadas em Triton X-0.2/PBS a 100% em gelo por 10 min. Os anticorpos primários foram incubados em 3% de albumina de soro bovino (BSA) em PBS durante a noite a 4°C. Após lavagens com PBS, as células foram incubadas durante 1 h em anticorpos secundários conjugados apropriados à espécie, Alexa488- ou Alexa546- (diluído 1:1000) e 0.1 ?g/mL DAPI (Sigma) em 3% BSA/PBS. As mitocôndrias foram visualizadas por imunofluorescência anti-Tom20 ou incubando células em 200 nM MitoTracker Red CMXRos (Molecular Probes, Inc.) em DMEM sem soro por 30 min a 37°C antes da fixação.
Microscopia e Análise de Imagem
As amostras de imunofluorescência foram visualizadas num microscópio LSM710 Confocal (Carl Zeiss). Micrografias foram capturadas usando objetivas de imersão em óleo 63X ou 100X e imagens ajustadas e aprimoradas usando o Adobe Photoshop CS6. A análise de co-localização foi realizada usando o recurso de co-localização Carl Zeiss LSM710 com limites definidos manualmente, mas sem a identidade das amostras. Barras de escala, salvo indicação em contrário, são 10 µm. A morfologia mitocondrial foi avaliada por pontuação cega. Se as mitocôndrias de uma célula fossem mantidas como puncta múltipla, redonda e discriminada, a célula era pontuada como 'fissão'. Se as mitocôndrias individuais fossem indistinguíveis e toda a rede mitocondrial parecesse contínua, a célula era classificada como "fusão". Todas as outras células, incluindo aquelas com mitocôndrias em cluster, foram classificadas como 'intermediárias'.
Fraccionamentos Subcelulares
As células RPE-1 foram cultivadas até a confluência. Após uma lavagem com PBS, as células foram submetidas a centrifugação a 600×g por 10 min e ressuspensas em 600 μL de tampão de isolamento (Manitol 210 mM, Sacarose 70 mM, MOPS 5 mM, EDTA 1 mM pH 7.4 + PMSF 1 mM). A suspensão foi lisada 30 vezes em um homogeneizador Dounce. Uma fração do homogenato foi preservada como um “lisado de célula inteira”. O restante foi submetido à centrifugação a 800×g por 10 min para sedimentar os núcleos. Os sobrenadantes foram submetidos a centrifugação a 1500×g durante 10 min para limpar os núcleos restantes e as células não lisadas. Este sobrenadante foi submetido a centrifugação a 15,000×g por 15 min para sedimentar as mitocôndrias. O sobrenadante foi preservado como a “fração citosólica”. O sedimento foi lavado suavemente com PBS e ressuspenso em tampão de isolamento. A concentração de proteína de cada fração foi medida por ensaio de ácido bicinconínico (BCA) e quantidades equivalentes de proteína foram resolvidas por SDS-PAGE.
Western blotting
As c�ulas foram lavadas em PBS e solubilizadas em tamp� solubilizante Laemmli concentrado 2 vezes (100 mM Tris [pH 6.8], 2% SDS, 0.008% de azul de bromofenol, 2% 2-mercaptoetanol, 26.3% de glicerol e 0.001%

Sulforafano é um produto químico da coleção isotiocianato de substâncias organossulfúricas obtidas a partir de vegetais crucíferos, incluindo brócolis, repolho, couve-flor, couve e couve, entre outros. O sulforafano é produzido quando a enzima mirosinase transforma a glucorafanina, um glucosinolato, em sulforafano, também conhecido como sulforafano-glicosinolato. Brotos de couve-flor e couve-flor têm a maior concentração de glucorafanina ou o precursor do sulforafano. Estudos de pesquisa demonstraram que o sulforafano aumenta a capacidade antioxidante do corpo humano para prevenir vários problemas de saúde.
Dr. Alex Jimenez DC, Insight CCST
Sulforafano e seus efeitos sobre câncer, mortalidade, envelhecimento, cérebro e comportamento, doenças cardíacas e muito mais
Os isotiocianatos são alguns dos compostos vegetais mais importantes que você pode obter em sua dieta. Nisso
Seções principais:
- 00: 01: 14 - Câncer e mortalidade
- 00: 19: 04 - envelhecimento
- 00: 26: 30 - Cérebro e comportamento
- 00: 38: 06 - recapitulação final
- 00: 40: 27 - dose
Cronograma completo:
- 00: 00: 34 - Introdução do sulforafano, um dos principais focos do vídeo.
- 00: 01: 14 - Consumo de vegetais crucíferos e reduções na mortalidade por todas as causas.
- 00: 02: 12 - risco de câncer de próstata.
- 00: 02: 23 - risco de câncer de bexiga.
- 00: 02: 34 - Câncer de pulmão em risco de fumantes.
- 00: 02: 48 - risco de câncer de mama.
- 00: 03: 13 - Hipotético: e se você já tem câncer? (intervencionista)
- 00:03:35 - Mecanismo plausível de condução
o cancer e dados associativos de mortalidade. - 00: 04: 38 - Sulforafano e câncer.
- 00:05:32 - Evidência animal mostrando
mais forte, Efeito do extrato de brócolis no desenvolvimento do tumor de bexiga em ratos. - 00: 06: 06 - Efeito da suplementação direta de sulforafano em pacientes com câncer de próstata.
- 00: 07: 09 - Bioacumulação de metabólitos de isotiocianato no tecido mamário atual.
- 00: 08: 32 - Inibição de células estaminais de cancro da mama.
- 00: 08: 53 - Lição de História: os brassicas foram estabelecidos como tendo propriedades de saúde mesmo na Roma antiga.
- 00: 09: 16 - A capacidade do Sulforaphane de aumentar a excreção de carcinógeno (benzeno, acroleína).
- 00: 09: 51 - NRF2 como um interruptor genético através de elementos de resposta antioxidante.
- 00: 10: 10 - Como a ativação de NRF2 aumenta a excreção de carcinógenos via conjugados de glutationa-S.
- 00: 10: 34 - As couves-de-bruxelas aumentam a glutationa-S-transferase e reduzem os danos no DNA.
- 00: 11: 20 - Bebida de brócolis aumenta a excreção de benzeno em 61%.
- 00: 13: 31 - O homogenato de brócolis aumenta as enzimas antioxidantes nas vias aéreas superiores.
- 00: 15: 45 - Consumo de vegetais crucíferos e mortalidade por doenças cardíacas.
- 00: 16: 55 - Brócolis em pó melhora os lipídios no sangue e o risco geral de doenças cardíacas em diabéticos tipo 2.
- 00:19:04 - Começo de
envelhecimento seção. - 00:19:21 - A dieta enriquecida com sulforafano melhora
tempo de vida de besouros de 15 para 30% (em certas condições). - 00: 20: 34 - Importância da baixa inflamação para a longevidade.
- 00: 22: 05 - Os vegetais crucíferos e o pó de brócolis parecem reduzir uma grande variedade de marcadores inflamatórios em humanos.
- 00: 23: 40 - Recapitulação de vídeo intermediário: câncer, seções de envelhecimento
- 00: 24: 14 - Estudos com ratos sugerem que o sulforafano pode melhorar a função imunológica adaptativa na velhice.
- 00:25:18 - O sulforafano melhorou o crescimento do cabelo em um modelo de camundongo calvo.
Imagem em 00: 26: 10. - 00: 26: 30 - Início da seção do cérebro e comportamento.
- 00: 27: 18 - Efeito do extrato de brócolis no autismo.
- 00: 27: 48 - Efeito da glucorafanina na esquizofrenia.
- 00: 28: 17 - Início da discussão sobre depressão (mecanismo plausível e estudos).
- 00:31:21 - Estudo em camundongos usando 10 modelos diferentes de depressão induzida por estresse mostram que o sulforafano é igualmente eficaz como a fluoxetina (
prozac ). - 00: 32: 00 - Estudo mostra a ingestão direta de glucorafanina em camundongos é igualmente eficaz na prevenção da depressão do modelo de estresse de derrota social.
- 00: 33: 01 - Início da seção de neurodegeneração.
- 00: 33: 30 - Sulforafano e doença de Alzheimer.
- 00: 33: 44 - Sulforaphane e doença de Parkinson.
- 00: 33: 51 - Sulforaphane e doença de Hungtington.
- 00: 34: 13 - Sulforafano aumenta as proteínas de choque térmico.
- 00: 34: 43 - Início da seção de traumatismo cranioencefálico.
- 00: 35: 01 - Sulforafano injetado imediatamente após o TBI melhora a memória (estudo do mouse).
- 00: 35: 55 - Sulforafano e plasticidade neuronal.
- 00:36:32 - Sulforafano melhora a aprendizagem em
modelo de diabetes tipo II em camundongos. - 00:37:19 - Sulforafano e
Duchenne distrofia muscular. - 00: 37: 44 - Inibição da miostatina em células satélites musculares (in vitro).
- 00: 38: 06 - Recapitulação de vídeo tardio: mortalidade e câncer, danos no DNA, estresse oxidativo e inflamação, excreção de benzeno, doença cardiovascular, diabetes tipo II, efeitos no cérebro (depressão, autismo, esquizofrenia, neurodegeneração), via NRF2.
- 00: 40: 27 - Pensamentos em descobrir uma dose de brotos de brócolis ou sulforafano.
- 00: 41: 01 - Anedotas sobre brotar em casa.
- 00: 43: 14 - Nas temperaturas de cozimento e atividade de sulforafano.
- 00: 43: 45 - Conversão da bactéria intestinal do sulforafano da glucorafanina.
- 00: 44: 24 - Os suplementos funcionam melhor quando combinados com a mirosinase ativa de vegetais.
- 00: 44: 56 - Técnicas de cozinha e vegetais crucíferos.
- 00: 46: 06 - Isotiocianatos como sendo goitrogénios.
Agradecimentos
Sciencedirect.com/science/article/pii/S2213231716302750
Como o sulforafano é produzido?
O aquecimento diminui a atividade da proteína epithiospecifier e aumenta a formação de sulforafano em brócolis
Sumário
Sulforafano, um isotiocianato de brócolis, é um dos anticarcinógenos derivados de alimentos mais potentes. Este composto não está presente no vegetal intacto, antes é formado a partir do seu precursor glucosinolato, a glucorafanina, pela ação da mirosinase, uma enzima tioglucosidase, quando o tecido de brócolis é esmagado ou mastigado. No entanto, vários estudos demonstraram que o rendimento de sulforafano a partir da glucorafanina é

Pré-aquecer florzinhas de brócolis e brotos a 60 ° C aumentaram significativamente a formação de sulforafano (SF) catalisada por mirosinase em extratos de tecido vegetal após o esmagamento. Isto foi associado com diminuições na formação do sulforafano nitrilo (SF Nitrile) e da atividade da proteína epithiospecifier (ESP).
Palavras-chave: Brócolis, Brassica oleracea, Crucíferas, Câncer, Anticarcinogênio, Sulforafano, Sulforafane nitrilo, Proteína epithiospecifier, Quinona redutase
Em conclusão, o sulforafano é um fitoquímico encontrado em
Curated pelo Dr. Alex Jimenez
Referenciado de: Sciencedirect.com

Discussão de tópico adicional: Dor aguda nas costas
Dor nas costas é uma das causas mais prevalentes de incapacidade e perdeu dias de trabalho em todo o mundo. A dor nas costas atribui-se à segunda razão mais comum para visitas a consultórios, superada apenas por infecções respiratórias superiores. Aproximadamente 80 por cento da população experimentará dor nas costas pelo menos uma vez ao longo da vida. A coluna é uma estrutura complexa composta de ossos, articulações, ligamentos e músculos, entre outros tecidos moles. Por causa disso, lesões e / ou condições agravadas, como hérnia de discos, pode eventualmente levar a sintomas de dor nas costas. Lesões esportivas ou acidentes automobilísticos geralmente são a causa mais frequente de dor nas costas, no entanto, às vezes, o mais simples dos movimentos pode ter resultados dolorosos. Felizmente, opções alternativas de tratamento, como quiropraxia, podem ajudar a aliviar a dor nas costas através do uso de ajustes espinhais e manipulações manuais, melhorando o alívio da dor.

EXTRA EXTRA | TÓPICO IMPORTANTE: Recomendado Quiroprático El Paso, TX?
***
Publicar isenção de responsabilidade
Escopo de prática profissional *
As informações aqui contidas em "O que é sulforafano?" não se destina a substituir um relacionamento individual com um profissional de saúde qualificado ou médico licenciado e não é um conselho médico. Incentivamos você a tomar decisões de saúde com base em sua pesquisa e parceria com um profissional de saúde qualificado.
Informações do blog e discussões de escopo
Nosso escopo de informações é limitado à Quiropraxia, musculoesquelética, acupuntura, medicamentos físicos, bem-estar, contribuindo etiológico distúrbios viscerossomáticos dentro de apresentações clínicas, dinâmica clínica de reflexo somatovisceral associada, complexos de subluxação, questões de saúde sensíveis e/ou artigos, tópicos e discussões de medicina funcional.
Nós fornecemos e apresentamos colaboração clínica com especialistas de várias disciplinas. Cada especialista é regido por seu escopo profissional de prática e sua jurisdição de licenciamento. Usamos protocolos funcionais de saúde e bem-estar para tratar e apoiar o cuidado de lesões ou distúrbios do sistema músculo-esquelético.
Nossos vídeos, postagens, tópicos, assuntos e insights abrangem assuntos clínicos, problemas e tópicos relacionados e apoiam direta ou indiretamente nosso escopo de prática clínica.*
Nosso escritório tentou razoavelmente fornecer citações de apoio e identificou os estudos de pesquisa relevantes que apoiam nossas postagens. Fornecemos cópias dos estudos de pesquisa de apoio à disposição dos conselhos regulatórios e do público mediante solicitação.
Entendemos que cobrimos questões que requerem uma explicação adicional de como isso pode ajudar em um plano de cuidados ou protocolo de tratamento específico; portanto, para discutir melhor o assunto acima, sinta-se à vontade para perguntar Dr. Alex Jiménez, DC, ou contacte-nos 915-850-0900.
Estamos aqui para ajudar você e sua família.
Bênçãos
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
o email: coach@elpasofunctionalmedicine. com
Licenciado como Doutor em Quiropraxia (DC) em Texas & Novo México*
Licença DC do Texas # TX5807, Novo México DC Licença # NM-DC2182
Licenciada como Enfermeira Registrada (RN*) em Florida
Licença da Flórida RN License # RN9617241 (Controle nº 3558029)
Status compacto: Licença Multiestadual: Autorizado para exercer em Estados 40*
Atualmente matriculado: ICHS: MSN* FNP (Programa de Enfermeira de Família)
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Meu cartão de visita digital



 Mais uma vez, damos as boas-vindas a você¸
Mais uma vez, damos as boas-vindas a você¸
